PARA CONOCER MAS A FONDO SOBRE LOS RADICALES ES RECOMENDADO VER EL SIGUIENTE VIDEO.
viernes, 2 de marzo de 2018
SEMANA 7
Hidrocarburos
Son todos aquellos compuestos que resultan de la combinación de los elementos químicos carbono e hidrógeno. Los hidrocarburos surgen en la naturaleza y por ende son los principales compuestos de la química orgánica, siendo sus máximos representantes el petróleo (hidrocarburo en estado líquido) y el gas natural (hidrocarburo en estado gaseoso).

Estos compuestos se producen durante millones de años en la profundidad de la tierra y son provenientes de la descomposición de plantas y animales de épocas antiguas.
Los hidrocarburos se componen de átomos de carbono que se entrelazan con átomos de hidrógeno y se dividen en dos grandes grupos: alifáticos (alcanos, alquenos y alquinos) y aromáticos.
Los alcanos son aquellos que presentan enlaces sencillos, los alquenos poseen enlaces dobles y los alquinos son los que cuentan con enlaces triples.
Por otro lado, los hidrocarburos pueden salir al exterior (desde el interior de la tierra) de manera natural o a través de la explotación o perforación de sus yacimientos.
Con el pasar de los años y con el surgimiento de la revolución industrial, los hidrocarburos tomaron muchísima importancia para el desarrollo económico, dado que una vez procesados, los mismos pueden dar origen a una gran cantidad de productos que son utilizados en la cotidianidad.
Por ejemplo, pueden ser transformados en combustibles para generar energía y/o tener un uso industrial, para la fabricación de diversos productos como asfalto, plásticos, cosméticos, lubricantes de vehículos, entre otros. Incluso, el gas en su forma natural es utilizado en el día a día de los seres humanos, para la utilización de las cocinas y así preparar alimentos.
Pero, a pesar de que los hidrocarburos se presentan como muy positivos, también tienen sus efectos negativos sobre el medio ambiente y los humanos. Los mismos pueden ocasionar afecciones respiratorias, llegando a generar intoxicaciones graves. Además, en el caso del petróleo si éste es derramado por algún transporte marítimo o al ser explotado, al entrar en contacto con el agua produce la contaminación la misma.
En otros planetas como Júpiter, Saturno, Titán y Neptuno se han encontrado hidrocarburos que han surgido sin necesidad de que haya habido vida para generarlos. Éstos están compuestos parcialmente por metano o el etano.
SEMANA 6
Hibridación del Carbono
Existen innumerables moléculas en que determinados elementos químicos establecen un cierto numero de enlaces covalentes comunes, más allá que estos enlaces no estuviesen previstos por la configuración electrónica de los átomos de esos elementos.
En el intento de explicar lo que sucede, se creó la teoría de la hibridación.
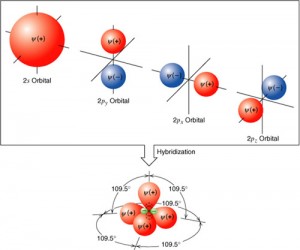
La palabra hibridación muchas veces se refiere al cruce de dos especies diferentes entre si, dando origen a una nueva especie, de características intermedias a aquellas de las especies de origen.
Es más o menos esa la idea que debemos tener en relación a la hibridación de orbitales.
Como el elemento carbono sufre varios tipos diferentes de hibridación y es un elemento químico muy importante, usaremos el carbono para ejemplificar la teoría de la hibridación.
Hibridación sp³ del carbono
Si observamos la configuración electrónica del átomo de carbono en estado fundamental, podemos concluir que el realiza apenas 2 enlaces covalentes comunes, porque posee apenas dos electrones desemparejados.
Experimentalmente esto no se verifica
El carbono, en las diversas moléculas que forma, realiza siempre 4 enlaces covalentes comunes. Es necesario admitir por tanto, que el carbono posee cuatro electrones desemparejados. La explicación acepta actualmente para este hecho la damos a continuación.
Un electrón orbital 2s del carbono es activado y promovido para el orbital 2pz, que estaba vacío, una vez que la diferencia de energía entre esos orbitales no es muy acentuada.
El carbono puede realizar 4 enlaces del tipo sigma. En este caso, todos son iguales y de igual energía y por tanto, los electrones deben estar ocupando orbitales iguales.
Esto no se verifica en el estado activado
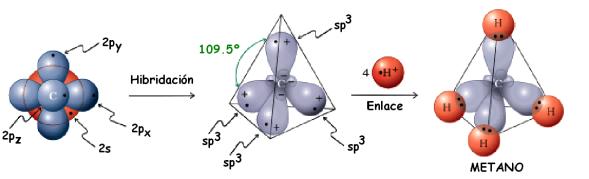
Así, sucede una hibridación (mezcla, cruza) entre el orbital s y los 3 orbitales p de la capa de valencia del carbono, originando 4 orbitales nuevos e iguales denominados sp3
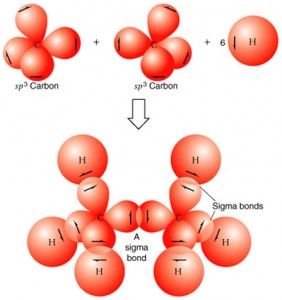
Como las cargas eléctricas del mismo signo se repelen, es lógico pensar que estos 4 electrones van a buscar orientar sus orbitales en una configuración espacial que les permita quedarse lo más distante posible unos de los otros.
La matemática prevé que la distancia máxima entre 4 ejes, se da en un ángulo de 109º28’.
Podemos visualizar, imaginando esos 4 ejes partiendo del centro de una pirámide tetraédrica y siguiendo en dirección a sus vértices.
De esto se concluye que la orientación de los 4 orbitales sp3 en el espacio sea exactamente esa, siempre considerando que el núcleo de carbono ocupe el centro de la pirámide tetraédrica imaginaria.
Resumiendo: el carbono que realiza cuatro enlaces sigma tiene:
- Hibridación sp3
- Geometría Tetraédrica
- Ángulo entre los orbitales híbridos de 109º28’
Otros elementos de la familia del carbono, el silicio y el germanio forman moléculas como SiH4, SiCl4, GeH4 e GeCl4, a través de ese mismo tipo de hibridación.
SEMANA 5
Quimica organica
La química orgánica o química del carbono es la rama de la química que estudia una numerosa clase de moléculas que contienen carbono, formando enlaces covalentes carbono-carbono y carbono-hidrógeno, también conocidos como compuestos orgánicos. Su riqueza es abrumadora. Originalmente, la química orgánica se confundió con la bioquímica, al estar la química de la vida basada mayoritariamente en la química del carbono. Desde la primera síntesis de urea en un laboratorio, que demostró que la química orgánica no era fundamentalmente distinta de la química convencional, se han realizado enormes avances teóricos y metodológicos, se han sintetizado y descrito millones de compuestos orgánicos y se han basado ramas enteras de la industria en las reacciones químicas orgánicas.

La química orgánica o química del carbono es la rama de la química que estudia una numerosa clase de moléculas que contienen carbono, formando enlaces covalentes carbono-carbono y carbono-hidrógeno, también conocidos como compuestos orgánicos. Su riqueza es abrumadora. Originalmente, la química orgánica se confundió con la bioquímica, al estar la química de la vida basada mayoritariamente en la química del carbono. Desde la primera síntesis de urea en un laboratorio, que demostró que la química orgánica no era fundamentalmente distinta de la química convencional, se han realizado enormes avances teóricos y metodológicos, se han sintetizado y descrito millones de compuestos orgánicos y se han basado ramas enteras de la industria en las reacciones químicas orgánicas.

SEMANA 4
Teoria cinetica de los gases
 La teoría cinética puede considerarse como una rama de la termodinámica estadística ya que deduce propiedades macroscópicas de la materia a partir de propiedades moleculares. Los principios en los que se fundamenta son los siguientes:
La teoría cinética puede considerarse como una rama de la termodinámica estadística ya que deduce propiedades macroscópicas de la materia a partir de propiedades moleculares. Los principios en los que se fundamenta son los siguientes:
La teoría cinética de los gases permite deducir las propiedades del gas ideal empleando un modelo en el que las moléculas del gas son esferas que cumplen las leyes de la mecánica clásica.
Las propiedades calculables mediante este modelo son: presión del gas, distribución de velocidades moleculares, velocidad molecular media, velocidad de colisión y distancia media entre colisiones. Estas propiedades permiten el estudio de la cinética de reacciones en fase gaseosa así como el flujo de fluidos y la transmisión de calor.
Fundamentos de la teoría cinético-molecular de los gases
 La teoría cinética puede considerarse como una rama de la termodinámica estadística ya que deduce propiedades macroscópicas de la materia a partir de propiedades moleculares. Los principios en los que se fundamenta son los siguientes:
La teoría cinética puede considerarse como una rama de la termodinámica estadística ya que deduce propiedades macroscópicas de la materia a partir de propiedades moleculares. Los principios en los que se fundamenta son los siguientes:- Un gas está formado por un gran número de partículas esféricas cuyo tamaño es despreciable comparado con la distancia entre las partículas.
- Las moléculas se mueven en línea recta a gran velocidad y sólo interaccionan cuando colisionan. Los choques entre partículas y con las paredes del recipiente se consideran perfectamente elásticos, conservándose la energía cinética traslacional.
- La teoría cinética supone que las partículas obedecen las leyes de Newton. Esta suposición es incorrecta (las moléculas cumplen las leyes de la mecánica cuántica) y conduce a resultados incorrectos en la predicción de las capacidades caloríficas del gas, aunque da resultados aceptables en propiedades como presión o difusión.
SEMANA 3
Leyes de los gases |
Ley de Avogadro
Esta ley relaciona la cantidad de gas (n, en moles) con su volumen en litros (L), considerando que la presión y la temperatura permanecen constantes (no varían).
El enunciado de la ley dice que:
El volumen de un gas es directamente proporcional a la cantidad del mismo.
Esto significa que:
Si aumentamos la cantidad de gas, aumentará el volumen del mismo.
Si disminuimos la cantidad de gas, disminuirá el volumen del mismo.
Esto tan simple, podemos expresarlo en términos matemáticos con la siguiente fórmula:
que se traduce en que si dividimos el volumen de un gas por el número de moles que lo conforman obtendremos un valor constante.
 |
| Tan simple como: más gas, mayor volumen. |
Esto debido a que si ponemos más moles (cantidad de moléculas) de un gas en un recipiente tendremos, obviamente, más gas (más volumen), así de simple.
Esto se expresa en la ecuación
Veamos un ejemplo práctico y sencillo:
Tenemos 3,50 L de un gas que, sabemos, corresponde a 0,875 mol. Inyectamos gas al recipiente hasta llegar a 1,40 mol, ¿cuál será el nuevo volumen del gas? (la temperatura y la presión las mantenemos constantes).
Solución:
Aplicamos la ecuación de la ley de Avogadro:
y reemplazamos los valores correspondientes:
resolvemos la ecuación, multiplicando en forma cruzada:
Ahora, despejamos V 2 , para ello, pasamos completo a la izquierda el miembro con la incógnita (V 2 ), y hacemos:
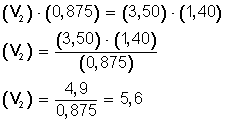
Respuesta:
El nuevo volumen (V 2 ), ya que aumentamos los moles hasta 1,40 (n 2 ), es ahora 5,6 L
Ley de Boyle
Esta ley nos permite relacionar la presión y el volumen de un gas cuando la temperatura es constante.
La ley de Boyle (conocida también como de Boyle y Mariotte) establece que la presión de un gas en un recipiente cerrado es inversamente proporcional al volumen del recipiente, cuando latemperatura es constante .
La ley de Boyle (conocida también como de Boyle y Mariotte) establece que la presión de un gas en un recipiente cerrado es inversamente proporcional al volumen del recipiente, cuando latemperatura es constante .
Lo cual significa que:
El volumen de un gas es inversamente proporcional a la presión que se le aplica:
En otras palabras:
Si la presión aumenta, el volumen disminuye.
Si la presión disminuye, el volumen aumenta.
Esto nos conduce a que, si la cantidad de gas y la temperatura permanecen constantes, el producto de la presión por el volumen siempre tiene el mismo valor .
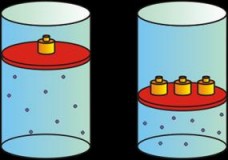 |
| Presión y volumen: si una sube, el otro baja. |
Matemáticamente esto es:
lo cual significa que el producto de la presión por el volumen es constante.
Para aclarar el concepto:
Tenemos un cierto volumen de gas (V 1 ) que se encuentra a una presión P 1 . Si variamos la presión a P 2 , el volumen de gas variará hasta un nuevo valor V 2 , y se cumplirá:
que es otra manera de expresar la ley de Boyle.
Apliquemos la fórmula en un ejemplo práctico:
Tenemos 4 L de un gas que están a 600 mmHg de presión. ¿Cuál será su volumen si aumentamos la presión hasta 800 mmHg? La temperatura es constante, no varía.
Solución:
Como los datos de presión están ambos en milímetros de mercurio (mmHg) no es necesario hacer la conversión a atmósferas (atm). Si solo uno de ellos estuviera en mmHg y el otro en atm, habría que dejar los dos en atm.
Aclarado esto, sustituimos los valores en la ecuación P 1 V 1 = P 2 V 2 .
Ponemos a la izquierda el miembro con la incógnita
Despejamos V 2 :
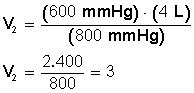
Respuesta:
Si aumentamos la presión hasta 800 mmHg el volumen disminuye hasta llegar a los 3 L.
Ley de Charles
Mediante esta ley relacionamos la temperatura y el volumen de un gas cuando mantenemos la presión constante.
Textualmente, la ley afirma que:
Textualmente, la ley afirma que:
El volumen de un gas es directamente proporcional a la temperatura del gas.
En otras palabras:
Si aumenta la temperatura aplicada al gas, el volumen del gas aumenta.
Si disminuye la temperatura aplicada al gas, el volumen del gas disminuye.
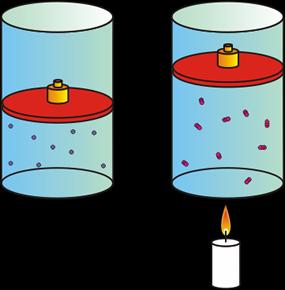 |
| A mayor temperatura, mayor volumen. |
Como lo descubrió Charles, si la cantidad de gas y la presión permanecen constantes, el cociente entre el volumen (V) y la temperatura (T) siempre tiene el mismo valor (K) (es constante).
Matemáticamente esto se expresa en la fórmula
lo cual significa que el cociente entre el volumen y la temperatura es constante.
Intentemos ejemplificar:
Supongamos que tenemos un cierto volumen de gas V 1 que se encuentra a una temperatura T 1 . Si aumentamos la temperatura a T 2 el volumen del gas aumentará hasta V 2 , y se cumplirá que:
que es otra manera de expresar la ley de Charles.
Veamos un ejemplo práctico y sencillo:
Un gas cuya temperatura llega a 25° C tiene un volumen de 2,5 L. Para experimentar, bajamos la temperatura a 10° C ¿Cuál será su nuevo volumen?
Solución:
El primer paso es recordar que en todas estas fórmulas referidas a la temperatura hay que usar siempre la escala Kelvin.
Por lo tanto, lo primero es expresar la temperatura en grados Kelvin:
Por lo tanto, lo primero es expresar la temperatura en grados Kelvin:
T 1 = (25 + 273) K= 298 K
T 2 = (10 + 273 ) K= 283 K
Ahora, sustituimos los datos en la ecuación:
Ahora, despejamos V 2 :
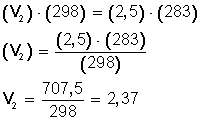
Respuesta:
Si bajamos la temperatura hasta los 10º C (283º K) el nuevo volumen del gas será 2,37 L.
Ley de Gay-Lussac
Esta ley establece la relación entre la presión (P) y la temperatura (T) de un gas cuando el volumen (V) se mantiene constante, y dice textualmente:
La presión del gas es directamente proporcional a su temperatura.
Esto significa que:
Si aumentamos la temperatura, aumentará la presión.
Si disminuimos la temperatura, disminuirá la presión.
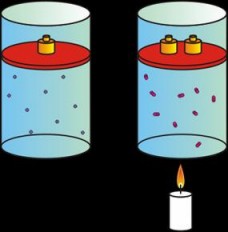 |
| A mayor temperatura, mayor presión. |
Si lo llevamos al plano matemático, esto queda demostrado con la siguiente ecuación:
la cual nos indica que el cociente entre la presión y la temperatura siempre tiene el mismo valor; es decir, es constante.
Llevemos esto a la práctica y supongamos que tenemos un gas, cuyo volumen (V) no varía, a una presión P 1 y a una temperatura T 1 . Para experimentar, variamos la temperatura hasta un nuevo valor T 2 , entonces la presión cambiará a P 2 , y tendrá que cumplirse la siguiente ecuación:
que es la misma Ley de Gay-Lussac expresada de otra forma.
Debemos recordar, además, que esta ley, al igual que la de Charles, está expresada en función de la temperatura absoluta, y tal como en la Ley de Charles, las temperaturas han de expresarse en grados Kelvin.
Veamos un ejemplo:
Tenemos un cierto volumen de un gas bajo una presión de 970 mmHg cuando su temperatura es de 25° C. ¿A qué temperatura deberá estar para que su presión sea 760 mmHg?
Solución:
Lo primero que debemos hacer es convertir los 25º C a grados Kelvin:
T 1 = (25 + 273) K= 298 K
Ahora sustituimos los datos en la ecuación:
Ahora despejamos T 2 :
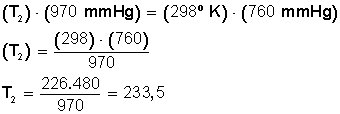
Respuesta:
La temperatura debe bajar hasta los 233,5º Kelvin. Si convertimos estos grados en grados Celsius hacemos
233,5 − 273 = −39,5 °C.
233,5 − 273 = −39,5 °C.
Ley general de los gases o ecuación general de los gases
Las leyes parciales analizada precedentemente pueden combinarse y obtener una ley o ecuación que relaciones todas las variables al mismo tiempo.
Según esta ecuación o ley general
Esto significa que, si tenemos una cantidad fija de gas y sobre la misma variamos las condiciones de presión (P), volumen (V) o temperatura (T) el resultado de aplicar esta fórmula con diferentes valores, será una constante.
Veamos un ejemplo, para aclarar:
Supongamos que tenemos una cierta cantidad fija de un gas (n 1 ), que está a una presión (P 1 ), ocupando un volumen (V 1 ) a una temperatura (T 1 ).
Estas variables se relacionan entre sí cumpliendo con la siguiente ecuación:
Donde R es una constante universal conocida ya que se puede determinar en forma experimental.
La misma fómula nos permite calcular el volumen molar de un gas (n) :
A modo de experimento, a la misma cantidad fija de gas (n 1 ) le cambiamos el valor a alguna de las variables tendremos entonces una nueva presión (P 2 ), un nuevo volumen (V 2 ) y una nueva temperatura (T 2 ).
Como ya conocemos le ecuación general colocamos en ella los valores de cada variable:
Según la condición inicial:
Según la condición final:
Vemos que en ambas condiciones la cantidad de gas (n 1 ) es la misma y que la constante R tampoco varía.
Entonces, despejamos n 1 R en ambas ecuaciones:
Marcamos con rojo n 1 R para señalar que ambos resultados deben ser iguales entre sí, por lo tanto:
Suscribirse a:
Entradas (Atom)