PROPIEDADES QUIMICAS DE LOS ALCOHOLES
Reacciona rápido y el sodio sale a la superficie. Y la temperatura en el tubo de ensayo aumenta.
2C5H11OH + 2Na ( 2C5H11ONa + H2
Reacciona lentamente y el sodio tarda un tiempo en salir a la superficie. En el tubo de ensayo demora en tener calor.
2C5H11OH + 2Na ( 2C5H11ONa + H2
El ácido sulfúrico está en la parte baja. Y no llegan a juntarse por lo tanto no hay reacción. Pero al agitarlo el alcohol amílico toma un color anaranjado claro.
C5H11OH + H2SO4 ( C5H11-SO4H + H2O
El ácido sulfúrico se mezcla con el alcohol isoamilico y el tubo de ensayo tiene una determinado temperatura.
C5H11OH + H2SO4 ( C5H11-SO4H + H2O
No hay reacción, el sodio se mantiene en la superficie.
C5H11OH + H2SO4 + Na ( C5H11-SO4HNa + H2O
No hay reacción, el sodio se mantiene en la superficie.
C5H11OH + H2SO4 + Na ( C5H11-SO4HNa + H2O
Es un poco soluble en el agua. Se torna viscosa la composición.
El H2SO4 se va en la parte baja de tubo de ensayo y al agitarlo se forman burbujas que haciende a la superficie del tubo de ensayo. Es más soluble en agua.
El sodio se evapora lentamente, el agua se encuentra en la parte baja y es menos soluble en el agua. En esta reacción se libera hidrogeno.
El sodio se evapora, el agua se encuentra en la parte baja del tubo de ensayo, también libera hidrogeno. Reacciona rápidamente que el alcohol amílico.

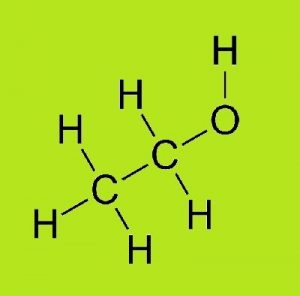
EQUIPO #2.
- Juan Manuel Lopera (coordinador)
- Daniel Tamayo Salazar
- Andrés Felipe Zapata
- Juan Andrés Cataño
TEMAS:
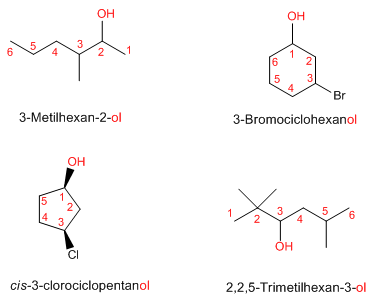
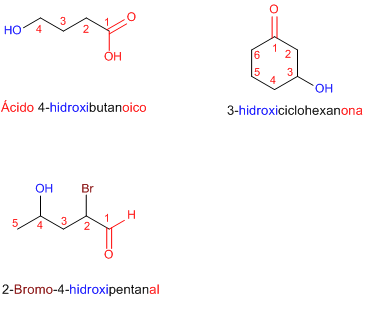
- Nomenclatura de los alcoholes
- para que se utilizan los alcoholes.
- como se forman los alcoholes
trabajo de practica: ¿como obtener alcoholes mediante a fermentación?
Pregunta anatematizadora: ¿Cómo funciona la nomenclatura en el grupo de los alcoholes y como obtener alcoholes mediante la fermentación?